انسولین برای اثر بر
سلولهای
هدف، ابتدا به گیرندههای پروتئینی غشا متصل میشود و آنها را فعال میکند. آنچه باعث اثرهای بعدی میشود، گیرنده فعال شده
است، نه انسولین. گیرنده α انسولین تترامری مرکب از چهار زیرواحد است: دو زیرواحد
گلیکوپروتئینی آلفا و دو زیرواحد گلیکوپروتئینی بتا. همه α این زیرواحدها روی یک mRNA واحد سنتز و سپس به روش پروتئولیتیک از
یکدیگر جدا و توسط پلهای دیسولفیدی به یکدیگر متصل میشوند. انسولین به زیرواحدهای آلفا که در خارج
سلول قرار دارند، متصل و باعث اتوفسفوریله شدن زیرواحدهای بتا در رادیکالهای تیروزین میشود. بنابراین، گیرنده
انسولین نمونهای
از گیرندههای
مرتبط با آنزیم است. اتوفسفوریلاسیون زیرواحدهای بتای گیرنده، یک تیروزین کیناز
موضعی را فعال میکند و این آنزیم موجب
فسفوریلاسیون تعداد دیگری از آنزیمهای داخل سلولی در محل رادیکالهای سرین و ترئونین،
از جمله گروهی به نام سوبسترای رسپتور انسولین (IRS) میشود. انواع مختلفی از
IRS
(مثل IRS1،
IRS2
و IRS3)
در بافتهای
مختلف بیان میشوند. اثر نهایی،
فعال کردن برخی دیگر از این آنزیمها و در عین حال غیرفعال کردن برخی دیگر است. بدین ترتیب،
انسولین ماشین متابولیک سلولی را در جهت ایجاد اثرهای مورد نظر بر متابولیسم
کربوهیدرات، چربی و پروتئین پیش میبرد.
باید دانست که IRS فقط قسمتی از
داستان است. موشهایی
که ژن رسپتور انسولین از آنها حذف شده است، تأخیر بارزی در رشد رحم، ناهنجاریهای دستگاه عصبی
مرکزی و پوست نشان میدهند و در زمان تولد به علت نارسایی تنفسی میمیرند؛ اما موشهایی که در آنها ژن 1-IRS حذف شده است و فقط
تأخیر متوسط در رشد رحم را نشان میدهند، زنده میمانند و نسبت به انسولین مقاوماند، اما از سایر جهات تقریباً طبیعی
هستند. به این ترتیب، مسیرهای درون سلولی که در آنها 1-IRS دخالت ندارد، باید در عمل انسولین دخالت
داشته باشند. یک مسیر عمل انسولین از طریق Ras و MAP کیناز برای پیشبرد نسخهبرداری از بعضی mRNAهاست. هنگامی که
انسولین به رسپتور میچسبد، رسپتورها به صورت قطعاتی دور یکدیگر جمع و احتمالاً به روش آندوسیتوز
با میانجیگری رسپتورها به داخل سلول برده میشوند. سرانجام، مجموعههای انسولینـگیرنده وارد لیزوزومها میشوند و رسپتورها ظاهراً در آنجا
تجزیه میشوند، یا مجدداً مورد
استفاده قرار میگیرند. نیمهعمر رسپتور انسولینی
حدود هفت ساعت است (2و3).
گیرندههای تیروزین کینازی (RTKs)، مانند گیرنده
انسولین، خانواده بزرگی از گیرندههای غشای پلاسمایی با فعالیت ذاتی پروتئین کینازی هستند، که
پیامهای
خارج سلولی را توسط مکانیسمی متفاوت به GPCRها انتقال میدهند. گیرندههای RTK دمین اتصال به لیگاند در سطح خارج سلولی
غشای پلاسمایی و یک جایگاه فعال آنزیمی در سمت سیتوزولی دارند که بهوسیله یک بخش گذار
غشایی به یکدیگر متصل میشوند. دمین سیتوپلاسمی یک پروتئین کیناز است که آمینواسیدهای Try موجود روی پروتئینهای ویژه هدف را
فسفریله میکند؛
گیرنده انسولین و گیرنده فاکتور رشد اپیدرمی، مثالهای بارز این نوع گیرندهها هستند (4).
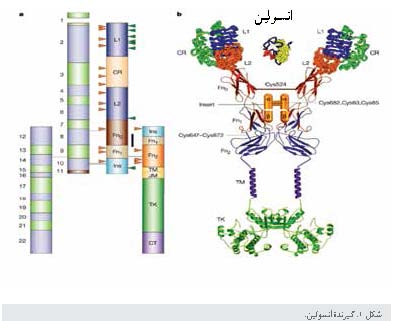
ساختار
و بیان زیر واحدهای گیرنده انسولین
ژن و mRNAی گیرنده انسولین
انسانی روی کروموزوم 19 قرار دارد و بیش از 150 کیلوباز است. اگزونهای این ژن (22 اگزون) به چندین گونه mRNA (بین 5/9 -2/4
کیلو باز) که در مناطق ترجمه نشده 3 متفاوت هستند، رونویسی میشوند. اگزون 11 که
کدکننده یک قطعه آمینواسیدی 12تایی در بخش cـترمینال زیرواحد α است، در انسان و پستانداران پست با یک الگوی
خاص، حفظ شده است (شکل1).
فراوانی mRNA و پروتئین گیرنده به وسیله تمایز سلولهای پیشساز آدیپوسیت و عضله
بهعنوان
فنوتیپ حساسیت انسولینی به صورت تنظیم افزایشی1 تنظیم میشود. در برخی سلولها، قرار گرفتن در معرض انسولین،
فراوانی mRNA
گیرنده را کاهش میدهد که ممکن است در
تنظیم تعداد گیرنده در داخل بدن نقش داشته باشد. در موارد نادری از مقاومت شدید به
انسولین به خاطر جهشهایی در ژن گیرنده، کاهش شدیدی در فراوانی گیرنده مشاهده شده
است. با این حال، به نظر میرسد تغییر فراوانی گیرنده نقش عمدهای در اشکال رایج مقاومت به انسولین،
مانند چاقی یا دیابت نوع 2 دارد.
محصول اولیه ترجمه mRNA گیرنده انسولین یک
توالی α-ß خطی پیشساز گیرنده α انسولین
(پرورسپتور) است. توالی نشانه α 27 آمینواسیدی هیدروفوبیک در انتهای N ـ ترمینال زیرواحد α اجازه میدهد تا گیرنده طی فرایند حذف سیگنال
پپتید، وارد شبکه α آندوپلاسمی شود. پیشرسپتور اغلب به صورت پروتئولیتیک در
دستگاه گلژی توسط فیورین2 به زیرواحدهای مجزای α و ß در محل برش متشکل از چهار آمینواسید اساسی (Arg-Lys-Arg-Arg)،
ظاهراً بعد از ارتباط پل دی سولفید دو مولکول پرورسپتور، پردازش میشود (1).
ساختار گیرنده ـ
گیرنده انسولین از دو زیرواحد α خارج سلولی تشکیل شده است که هر کدام به یک زیرواحد ß و توسط باندهای دیسولفید به یکدیگر
متصل شدهاند (شکل 2). کاهش
اتصالات بین زیرواحدهای α، باعث تولید مونومرهای α-ß میشود که تمایل کمتری
به انسولین دارند و فاقد فعالیت تیروزین کینازی تحریک شده با انسولین هستند.
بازسازی این هترودایمرها به هتروتترامرهای دارای میل ترکیبی بالای اتصال به
انسولین و فعالیت کینازی تحریک شده با انسولین را بازیابی میکند.
زیرواحد بالغ α شامل 719 یا 731
آمینواسید (به دلیل پیرایش mRNA جایگزین اگزون 11) و دارای جرم مولکولی حدود KDa 130 است. زیرواحد α بهطور کامل خارج سلولی
و شامل محلهایی
اتصال برای انسولین است.
زیرواحد α درون غشایی ß شامل 620
آمینواسید است. جرم مولکولی تقریبی آن KDa95 است. زیرواحد ß سه بخش دارد: خارج سلولی، درون غشایی و
سیتوزولی. بخش سیتوزولی دارای فعالیت کاتالیتیکی تیروزین کینازی است که توسط
انسولین تنظیم میشود و با اعضای دیگر
خانواده تیروزین کیناز از نظر ساختاری بسیار همولوگ است.
بخش سیتوزولی زیرواحد
ß
دارای چندین زیر ـ دمین3 است: دمین مجاور غشایی؛ دمین کاتالیتیکی تیروزین کیناز،
که دارای محل اتصال به ATP و یک حلقه α فعالسازی با سه فاصله α تیروزینی فسفوریلهشده و دمین کربوکسیل ترمینال. هر دو زیرواحد گیرنده در طول
فرایند ترجمه، گلیکوزیله میشود و شامل مجموعه زنجیرههای جانبی کربوهیدرات-N با باقیماندههای اسید سیالیک
پایانهای
که برای تاخوردگی طبیعی و عملکرد گیرنده مورد نیاز است. همچنین جزء خارج سلولی
زیرواحد α
شامل الیگوساکاریدهای-O
است.
در سال 2006، بررسی
ساختار بلوری گیرنده نوترکیب دمین خارج سلولی4 نشان از یک ساختار منحصر
به فرد میداد (شکل3). انتهای N از دو دمین تکراری
کروی و غنی از لوسین ، به نامهای L1 و L2، تشکیل شده و دمین طرفین غنی از سیستئین است که از هشت بخش
تکراری مدولار سیستیین تشکیل شده است. انتهای C از سه نوع دمین تکرار فیبرونکتین III تشکیل شده است(FnIII1، 2 و 3). یک
موتیف ساختاری مشترک در دمینهای خارج سلولی پروتئینهای غشایی، اولی در زیرواحد α و سومی در زیرواحدα واقع شده است.
دمین غیرمعمول یا آتیپیک دوم حاوی 120 آمینواسید منظم، دمین الحاقی5 شامل محل شکاف α-ß است. این دمینها به فرم V معکوس تا خوردهاند، به طوری که رأس V از L2 و دمینهای تکراری اولین
فیبرونکتین نوع III تشکیل شده است (1).
ایزوفرمهای گیرنده انسولین ـ
هر چند توسط یک ژن واحد کد میشوند، ولی پیرایش جایگزین premRNA اگزون 11 در رونوشت گیرنده α انسولین تولید دو
ایزوفرم میکند، یکی با اگزون 11
(HIRB و یا + EX11) و یکی بدون اگزون 11 (HIRA و یا -EX11). بنابراین،
اشکال پروتئینی با حضور یا عدم حضور، به ترتیب 12 آمینواسید در پایانه α c زیرواحد α که توسط اگزون 11
کدگذاری شده است، متفاوتاند (شکل 1).
تفاوت در عملکرد
ایزوفرم ـ حفظ پیرایش اگزون 11 mRNA در گونههای مختلف نشان میدهد که احتمالاً دو
گیرنده دارای خواص عملکردی متمایز هستند؛ به رغم مطالعات فشرده، تفاوتهای عملکردی شناساییشده ناچیز است. شکل 11- EX از یک چهارم تا دو
برابر میل ترکیبی بیشتر به انسولین دارد و حتی ممکن است اینترنالیزه شود. تاکنون
مشخص نیست که آیا این دو شکل فعالیت کینازی متفاوت دارند یا خیر؟
نقش ایزوفرمها در بیماری ـ نقش
اشکال مختلف گیرنده در بیماری هنوز مورد بحث است. سطوح مختلف بیان در عضله، مقاومت
به انسولین (90 درصد فرم «B») در مقابل افراد حساس به انسولین (81 درصد) نشان داده شده است.
آیا این تغییرات میزان ایزوفرمهای گیرنده را تغییر میدهد یا نتایج زیستی دارد که در حال حاضر
ناشناخته است. در دیستروفی عضلانی میوتونیک، که با مقاومت انسولینی همراه است،
نتایج نقص پیرایش در همه گیرندههای انسولینی فرم A مشاهده شده است. در یک مدل این بیماری موش نقص جذب گلوکز تحریک
شده توسط انسولین در عضله مخطط مشاهده شده است.
اتصال انسولین ـ
مطالعه چگونگی اتصال انسولین به گیرنده نشان میدهد که کینتیک اتصال، با توجه به
ناهمگونی جایگاههای
اتصال انسولین6 و همکاری منفی در اتصال 7 و یا ترکیب این
دو، پیچیده است.
همکاری منفی ـ آزمایشهای کینتیک که در آنها اتصال انسولین در
غلظتهای
بالا، میل ترکیبی پایین و میزان گسست هورمون را افزایش میدهد، از وجود همکاری منفی اتصال انسولین
حکایت میکند. پیشنهاد شده است
که هر زیرواحد α
دایمرگیرنده شامل دو جایگاه اتصال متمایز، غیر یکسان برای انسولین است. بنابراین،
در غلظت پایین «فیزیولوژیک» انسولین، یک مولکول انسولین بهطور همزمان به هر دو مونومر گیرنده به شیوهای نامتقارن (با
استفاده از محلهای
اتصال غیریکسان) متصل میشود. هر دو جایگاه میل ترکیبی بالایی برای اتصال دارند. فرض میشود که تنها یکی از
دو جایگاه اتصال میتواند فعال شود،
اتصال یک مولکول دوم به انسولین، در حضور سطوح بالای غیرفیزیولوژیک انسولین، باعث
تغییر ساختاری منجر به تخریب در جایگاه اتصال مولکول اول انسولین و بنابراین کاهش
میل ترکیبی اتصال و در نهایت همکاری منفی میشود. مطالعات تجربی اتصال انسولین به هترودایمرهای α-ß پیشبینی میکند که اتصال انسولین
به این نوع گیرندهها به عنوان کلاس واحد میل ترکیبی پایین رخ میدهد (1).
جایگاه اتصال ـ محل(های) اتصال در
زیرواحدα
در ابتدا از این واقعیت استنباط میشد که این زیرواحد بهطور کامل خارج سلولی است. بر اساس شواهد
آزمایشگاهی جایگاه اصلی اتصال، جایگاه 1، از آمینواسیدهای شماره 704 -717 در دامین L1 در انتهای C دمین الحاقی
زیرواحد α
قرار دارد. جایگاه دوم اتصال انسولین، سایت 2 با میل ترکیبی پایین تر، از
فیبرونکتین تشکیل شده است(1).
برهمکنشهای زیرواحد گیرنده انسولین
اتصال انسولین به گیرنده باعث اتوفسفوریلاسیون
سریع گیرنده در زنجیرههای جانبی تیروزین میشود. به نظر میرسد این رویداد برای فعالسازی تیروزین کیناز و
عملکردهای
انسولین ضروری است. اتصالات عرضی دو مونومر گیرنده بهطور بالقوه ممکن است آنها را در یک ساختار
ثابت برای تسهیل ترانس فسفوریلاسیون دمینهای کاتالیزوری تیروزین کیناز که برای
فعالسازی
فعالیت کاتالیزوری آنها ضروری است، قرار دهد. جزئیات ساختاری این روند مبهم باقی
مانده است.
مطالعه ساختار بلوری
دمین خارج سلولی و شبیهسازیهای دینامیک مولکولی نشان میدهد که جایگاههای اتصال انسولین بهوسیله حرکات بالا و
پایین رفتن، درنتیجه تغییرات ناشی از توپولوژی دو مونومر منجر به باز و بستهشدن میشود. اتصال انسولین
باعث تثبیت یک جایگاه اتصالی در وضعیت «بسته» فعال میشود. همزمان با آن، باز شدن جایگاه دوم اجازه
دسترسی به مولکول دوم انسولین را میدهد. اتصال عرضی گیرنده توسط مولکول دوم انسولین تغییرات
ساختاری با جدا کردن انسولین اول معکوس میکند. تجزیه و تحلیل ساختارهای بلوری کمپلکسهای گیرنده انسولین ـ
انسولین برای روشن شدن مکانیسم اتصال انسولین بیشتر مورد نیاز است.
یک مکانیزم اضافی یا
جایگزینی فعال شدن گیرنده با مشاهده جابهجایی قطعه α-helical انتهای C زیرواحد α گیرنده در طول فرایند اتصال انسولین پیشنهاد
شده است. بنابراین، به نظر میرسد اتصال انسولین مجموعهای از تغییرات ساختاری پیچیده را در
دیمر دمین خارج سلولی گیرنده انسولین آغاز میکند که با عبور از عرض غشای سلولی به
دمین داخل سلولی میرسد.
اینکه چگونه تغییرات
ساختاری با انتقال به دمینهای داخل غشایی به دمینهای داخل سلولی گیرنده نیز منتقل میشود، هنوز به خوبی
شناخته نشده است. بهطور کلی به نظر میرسد در دمینهای تیروزین کیناز گیرنده انسولین به
وسیله برهمکنشهای دمین درونغشایی در یک ساختار
دایمری غیرفعال تثبیت شود. برهمکنشها با پپتید این برهمکنش را مختل و انتقال به ساختار فعال را
تسهیل میکند (1).
مکانیسم تنظیم دمین
کیناز ـ ساختار کریستالی دمین تیروزین کیناز گیرنده انسولین انسانی اطلاعات منحصر
به فردی در زمینه تنظیم فعالیت آنزیم گیرنده انسولین و مکانیسم اتوفسفوریلاسیون
فراهم کرده است. یک قطعه 306 آمینواسیدی زنجیره ß گیرنده انسولین انسانی، که شامل جایگاههای سه تیروزینی است،
برای فعالیت کینازی گیرنده به سوبستراهای اگزوژن مورد نیاز است. این قطعه
تیروزین کیناز در صورت اتوفسفوریلاسیون فعال میشود.
دادههای به دست آمده از
کریستالیزاسیون مکانیسم خودبازدارندگی8 را نشان میدهد. تیروزین 1162، یکی از سه تیروزین
موجود در دمین کیناز که به دنبال اتصال انسولین فسفوریله میشود، فضایی در جایگاه فعال اشغال میکند، که ظاهراً به
منظور سیس ـ اتوفسفوریلاسیون (فسفوریلاسیون به وسیله زیرواحدß) است. اما، گروه هیدروکسیل حلقه فنولی
تیروزین 1162 که هدف فسفوریلاسیون است به گروه کربوکسیل پایه کاتالیتیکی زیرواحدß (باقیمانده Asp1132)،
اتصال هیدروژن برقرار میکند و در این حالت یک پاکت اتصال برای ATP ایجاد میکند.
هنگامی که انسولین به
زیرواحد α
متصل میشود، تغییر ساختاری
ساختار چهارم زیرواحد ß، باعث حرکت تیروزین1162 از پاکت کاتالیتیکی دمین کیناز گیرنده میشود. در نتیجه،
جایگاههای
فسفوریلاسیون (در دمین سه تیروزینی) یک زنجیره ß در تماس با جایگاه فعال زنجیره ß دیگر قرار میگیرد. حرکت
تیروزین1162 اجازه میدهد تا با اتصال ATP و ترانس ـ فسفوریلاسیون زیرواحدß فعالیت کینازی و
باقیمانده تیروزین1162 از زیرواحد ß مجاور در هتروتترامر گیرنده شروع شود. در نهایت، سه تیروزین در
دمین کینازی فسفریله میشود و گیرنده کیناز بهطور کامل فعال میشود.
اتوفسفوریلاسیون
گیرنده و انتقال سیگنالـگیرنده انسولین عضو خانواده بزرگ ژنگیرنده تیروزین کیناز است که شامل
گیرندههای
EGF
و 9PDGF
است. تعیین تمایز بین این گیرندهها و خانواده بزرگتر گیرنده انسولین، از جمله گیرندهIGF1 و گیرنده انسولین مرتبط با گیرنده از موارد
مورد علاقه پژوهشگران است.
• گیرندههای EGF و PDGF مونومرهایی هستند در نتیجه اتصال لیگاند به
شکل دیمر غیرکووالانسی القا میشوند، ولی گیرنده انسولین، در هنگام عدم اتصال به لیگاند به
صورت یک دایمر کووالانسی از دو مونومر α , ß تشکیل شده است.
• تفاوت دوم بین این کلاس از گیرندهها این است که گیرندههای EGF و PDGF تشکیل کمپلکسهایی بین باقیماندههای فسفوریله تیروزین
خاص در گیرنده و میانجیهای پایین دست را از طریق دمین سیگنالینگ در پروتئینهای عملکننده که بهطور خاص به دمینهای فسفوریله تیروزین
گیرنده فسفریله متصل میشود. در مقابل، گیرنده انسولین فعال یک یا چند پروتئین
سوبسترای اصلی را در باقیماندههای تیروزین فسفوریله میکند، که سوبسترای گیرنده انسولین1 (IRS1) و IRS2 بهترین مشخصه هستند.
مطالعات در موش با
هتروزیگوسیتی ترکیبی برای گیرندههای انسولین، IRS1 و / یا IRS2 نشان از تفاوت ویژگی بافتی بین این دو سوبسترا است، با نقش غالب IRS1 در عضله اسکلتی و
IRS2
در کبد. همچنین به نظر میرسد IRS2 در سلولهای بتا مهم است، چون IRS2، هیپرپلازی جبرانی سلولهای بتا را در پاسخ
به مقاومت به انسولین نشان داد. دیگر مدلهای ناک اوت موش نشان میدهد که ممکن است
سیگنالینگ IRS2
نقش مهمی در تنظیم هیپوتالاموسی لپتین، حساسیت به انسولین محیطی، و احتمالا،
بازسازی سلولهای
بتا بازی کند(1).
جایگاههای اتوفسفوریلاسیون
تیروزینی و نواحی عملکردیـ هر دمین سیتوپلاسمی گیرنده دارای 13باقیمانده تیروزینی است.
هفت تیروزین، در سه دمین، در پاسخ به اتصال انسولین فسفوریله میشوند.
• مهمترین جایگاههای اتوفسفوریلاسیون و فعالیت تیروزین
کینازی سه باقیمانده
تیروزینی هستند (1158، 1162، و 1163) که در دمین کاتالیتیک تیروزین کیناز قرار
دارند (شکل4). فسفوریلاسیون این جایگاهها بهطور موقت فعالیت تیروزین کینازی را 10 تا 20 برابر
افزایش میدهد.
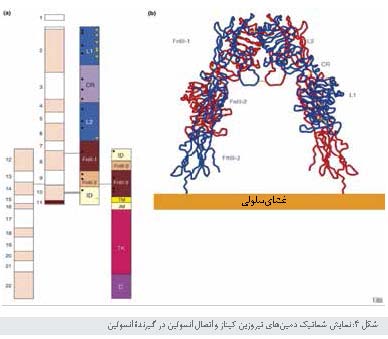
• مانند تمام پروتئین کینازها، گیرندههای انسولین یک توالی
آمینواسیدی کد کننده دامین اتصال ATP دارد (شکل4). این دمین شامل موتیف غنی از گلیسین (Gly-X-Gly-X-X-Gly)
است که پس از آن باقیمانده لیزین (1030) که با ATP میل ترکیبی دارد. تعویض این لیزین با سایر
آمینواسیدهای اتوفسفوریلاسیون و فعالیت کینازی را متوقف میکند.
• یک دمین مجاور غشایی داخل سلولی که
توسط اگزون 16 کد شده است شامل چندین تیروزین است، و در انتقال سیگنال و
اینترنالیزه شدن گیرنده نقش دارد. بنابراین احتمال دارد، که این دمین در تشخیص
سوبسترا نقش داشته باشد.
• نقش دمین C ترمینال گیرنده انسولین، که فراتر از دمین
تیروزین کیناز گسترده است، مشخص نیست. این دمین شامل دو تیروزین (1328و 1334) است
که فسفریله شده و به عنوان 40درصد از فسفوریلاسیون تحریک شده با انسولین محسوب میشود. انتهای C در تنظیم فعالیت
کینازی گیرنده و تجمع گیرنده و درونی شدن آن نقش دارد.
از آنجا که
هولورسپتور انسولین به عنوان یک دایمر کووالانسی از دو زیرواحد آلفاـبتا است، درک اهمیت
این که آیا عمل آغازی اتوفسفوریلاسیون و فعالیت کینازی به صورت سیسـ پروسس (یعنی خود
فسفوریلاسیون هر زیرواحد بتا) یا ترانسـ پروسس (یعنی زیرواحد بتا دیگری را
فسفوریله میکند) است؟ مطالعات
مختلف رسپتورهای
کایمر اشاره میکند که رویداد اولیه
ترانسفوریلاسیون است.
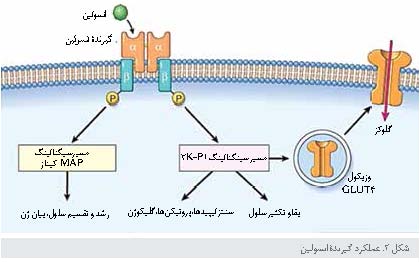
عملکرد گیرنده انسولین
انسولین آنزیمهای متابولیک و بیان
ژن را تنظیم میکند.
انسولین وارد سلول نمیشود ولی پیامی را آغاز میکند که یک مسیر منشعب را از گیرنده غشای
پلاسمایی به آنزیمهای حساس به انسولین در سیتوزول و به هسته طی و در آنجا بیان
ژنهای
خاص را تحریک میکند.
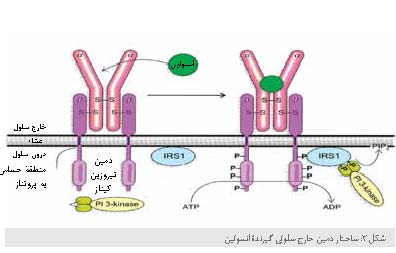
گیرنده فعال انسولین (INSR) شامل دو زیرواحد یکسان α است که از سمت خارج غشای پلاسمایی سلول
بیرون زدهاند و دو زیرواحد غشا
گذر
ß
که انتهای کربوکسیل آنها وارد سیتوزول شده است. زیرواحدهای α دارای دمین متصل شونده به انسولین هستند و
دمینهای
داخل سلول زنجیرههای ß فعالیت پروتئینکینازی دارند که گروه فسفریل را از مولکول ATP به گروه هیدروکسیل
ریشههای
Tyr
موجود در پروتئینهای هدف ویژه منتقل میکنند. پیامرسانی به وسیله INSR زمانی شروع میشود که انسولین باعث فعال شدن خاصیت
تیروزین کینازی شود و هر زیرواحد ß، سه ریشه Tyr مهم را در مجاورت انتهای کربوکسیل زنجیره ß دیگر فسفریله میکند. این اتوفسفوریلاسیون باعث باز شدن
جایگاه فعال آنزیم میشود، به طوری که آنزیم میتواند ریشههای Tyr سایر پروتئینهای هدف را فسفریله کند. مکانیسم فعال
شدن پروتئین کیناز INSR مشابه PKA و PKC است: منطقهای در دمین سیتوپلاسمی(توالی خودمهاری) که بهطور طبیعی جایگاه فعال را اشغال میکند، بعد از فسفریله
شدن برداشته میشود
و در نتیجه جایگاه اتصال به پروتئینهای هدف را باز میکند.
زمانی که INSR دچار
اتوفسفوریلاسیون شد، یکی از پروتئینهای هدف آن سوبسترایـ1گیرنده انسولین (1ـIRS) است. وقتی IRS-1 روی چندین ریشه Tyr خود فسفریله شد،
تبدیل به محل تجمع کمپلکسی از پروتئینها میشود که توسط تعداد زیادی از پروتئینهای واسطه، پیام را
از گیرنده انسولین به هدف نهایی در سیتوزول و هسته حمل میکند. ابتدا یک ریشه p-Tyr از 1ـIRS به دمین SH2 مشابه توالی دمین
Src
(تلفظ: Sark)
است که خود یک پروتئین کیناز دیگر است. تعداد زیادی از پروتئینهای پیامرسان دارای دمین SH2 هستند که همه آنها به ریشه p-Tyr در پروتئین شریک
خود متصل میشوند.
پروتئین Grb2
یک پروتئین آداپتور است که فعالیت آنزیمی ندارد. عمل آن نزدیک بودن دو پروتئین (در
این مورد، IRS1
و پروتئین SOs)
است که برای انتقال پیام باید با هم میانکنش دهند. پروتئین Grb2 علاوه بر دمین SH2 (اتصال به p-Tyr) دارای یک دمین ثانویه اتصال به پروتئین SH3 است که به مناطق
غنی از آمینواسید پرولین در SOs متصل میشود. پروتئین Grb2 به مناطق غنی از پرولین پروتئین SOs متصل میشود و باعث تشکیل یک کمپلکس رشد میشود. هنگامی که Grb2 به SOs متصل میشود، SOs بهعنوان فاکتور تعویضکننده نوکلئوتید (GEF) عمل میکند که جابهجایی GDP متصل به Ras را با GTP کاتالیز میکند، Ras نیز یک G پروتئین است.
پروتئین Ras
نمونهای
از اعضای خانواده پروتئینهای G کوچک است که واسطه انواع مختلفی از مسیرهای انتقال پیام هستند. پروتئین Ras مانند G پروتئینهای تریمری که با
سیستم ß
ـ آدرنرژیک عمل میکنند، میتواند در دو کانفورماسیون متصل به GTP (فعال) یا متصل به GDP (غیرفعال) باشد، ولی Ras (≈ 20 KDa) به صورت مونومر عمل میکند. هنگامی که GTP متصل میشوند، Ras میتواند پروتئین کینازی
بهنام
1ـ Rafرا
فعال کند. پروتئین1- Raf اولین مورد از سه پروتئین کیناز 1-Raf ،MEK و ERK است و آبشاری ایجاد میکند که در آن هر کیناز با فسفوریلاسیون،
دیگری را فعال میکند.
پروتئین کیناز MEK و ERK توسط فسفوریلاسیون هر دو ریشه Thr و Tyr فعال میشوند. هنگامی که ERK فعال شود، واسطه بعضی از اثرهای زیستی
انسولین توسط ورود به هسته و فسفوریلاسیون پروتئینهایی مثل EIK1 است که در هسته رونویسی حدود 100 ژن
تنظیمشونده
با انسولین را تنظیم میکنند. برخی از آنها پروتئینهای ضروری برای تقسیم سلولی را کد میکنند. بنابراین،
انسولین به عنوان یک فاکتور رشد عمل میکند.
پروتئینهای1-Raf را، MEK و ERK اعضای سه خانواده
بزرگ هستند که چندین نامگذاری در مورد آنها به کار گرفته میشود. پروتئین ERK عضوی از خانواده MAPK (پروتئین کیناز
فعال شده توسط میتوژن10، پیامهایی هستند که از خارج بر سلول اثر میکنند و باعث میتوز و تقسیم سلولی میشوند) است. بعد از
گذشت زمان کوتاهی از کشف اولین آنزیم MAPK، آنزیمی پیدا شد که توسط سایر پروتئین کیناز فعال میشد و بهنام MAP کیناز (MEK به این خانواده
تعلق دارد) نامیده شد. بعداً اختصاراتی برای این خانوادهها پیشنهاد شد، MAPKK ،MAPK و MAPKKK، کینازهای خانواده MAPK و MAPKKK برای ریشههای Ser یا Thr اختصاصی هستند. در حالی که MAPKKها (در اینجا، MEK) هر دو ریشه Ser و Tyr را در سوبسترای
خود، که نوعی MAPK است (در اینجا، ERK) فسفریله میکنند.
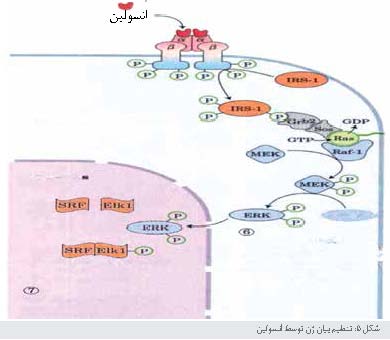
بیوشیمیدانها هم اکنون مسیر
انسولین را بهعنوان
یک مورد از طرح کلیتر میدانند که در آن پیامهای هورمونی از طریق مسیر مشابه با طرح
نشان داده شده در شکل5، سبب فسفوریلاسیون آنزیمهای هدف توسط پروتئین کینازها میشود. اغلب هدف
فسفوریلاسیون، پروتئین کیناز دیگری است که سپس پروتئین کیناز سوم را
فسفریله میکند
و الی آخر. نتیجه یک آبشار از سلسله واکنشهایی است که پیام اولیه را به صورت
توانی تقویت میکند.
آبشارهای
MAPK
واسطه پیامهای
شروع شونده با انواع وسیعی از فاکتورهای رشد مثل فاکتور رشد مشتق از پلاکت (PDGF) و فاکتور رشد
اپیدرمی (EGF)
هستند. طرح عمومی دیگر که با مسیر گیرنده انسولین مثال آورده میشود، استفاده از
پروتئینهای
آداپتور غیر آنزیمی برای کنار هم نگه داشتن اجزای یک مسیر منشعب است که اکنون به
آن اشاره خواهیم کرد.
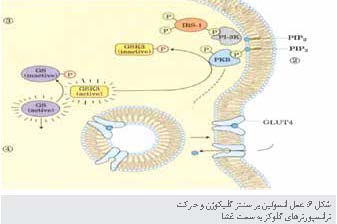
عملکرد فسفولیپید غشایی
در شاخهای
از پیامرسانی
انسولین
مسیر پیامرسانی از انسولین،
در1-IRS
شاخهدار
میشود. پروتئین Grb2 تنها پروتئینی
نیست که با1-IRS
فسفریله شده در ارتباط است. آنزیم فسفواینوزیتید 3-کیناز(PI3K) از طریق دمین SH2 مربوط به PI3K به 1-IRS متصل میشود (شکل6). بنابراین PI3K فعال شده،
فسفاتیدیل اینوزیتول 4، 5 ـ بیس فسفات غشایی را (PIP3) تبدیل میکند. گروه سر باردار شده PIP3 که به سمت
سیتوپلاسمی غشای پلاسمایی بیرون زده است، نقطه آغاز دوّمین شاخه پیامرسانی است که مستلزم
پروتئین کینازهای
دیگری است. پروتئین کیناز B (PKB)اا(AKt نیز نامیده میشود) با اتصال به PIP3 توسط پروتئین کیناز دیگری به نام PKD1 فسفریله و فعال
میشود.
سپس PKB
فعال شده ریشههای
Ser
و Thr
را در پروتئینهای
هدف خود که یکی از آنها گلیکوژن سنتاز کیناز 3(GSK3) است، فسفریله میکند. پروتئین GSK3 در فرم فعال و غیرفسفریله خود، گلیکوژن
سنتاز را فسفریله میکند که سبب غیرفعال شدن آن و کاهش سرعت سنتز گلیکوژن میشود. (این مکانیسم
تنها بخشی از اثرهای انسولین روی متابولیسم گلیکوژن است)، با فسفوریلاسیون GSK3 توسط PKB ،GSK3 غیرفعال میشود. بنابراین به
وسیله آن از غیرفعال شدن گلیکوژن سنتاز در کبد و ماهیچه جلوگیری شده و آبشاری از
فسفوریلاسیونهای
پروتئین شروع شده توسط انسولین، سنتز گلیکوژن را تحریک مینماید. در سومین شاخه پیامرسانی در بافت عضلانی
و چربی، PKB
باعث حرکت ناقلین گلوکز (GLUT4) به کمک کلاترین از وزیکولهای داخلی به غشای پلاسمایی شده و در
نتیجه باعث تحریک جذب گلوکز از خون میشود.
همانند تمام مسیرهای پیامرسانی، مکانیسمی برای
پایان پیام از طریق مسیر PI3K-PKB وجود دارد. یک فسفاتاز ویژه PIP3 PTEN) در انسانها) فسفات را از موقعیت 3 مربوط به PIP3 حذف و PIP2 تولید میکند که دیگر به عنوان
جایگاه اتصال برای PKB عمل نکرده و زنجیره پیام پایان مییابد. در انواع متفاوتی از سرطانها، اغلب سلولهای توموری در ژن PTEN نقص داشته و
بنابراین به صورت غیرطبیعی سطح بالایی از PIP3 و فعالیت PKB را دارند. درنتیجه به نظر میرسد یک پیام دائمی
برای تقسیم سلولی و بنابراین رشد تومور باشد.
گیرنده انسولین نمونه
شاخص تعدادی از آنزیمهای گیرنده با ساختار مشابه و فعالیت RTK است.
برای مثال، گیرندههای فاکتور رشد اپیدرمی (EGF) و فاکتور رشد مشتق از پلاکت (PDGF) دارای تشابه
ساختاری و توالی با INSR بوده و هر دو فعالیت پروتئین کینازی دارند که 1-IRS را فسفریله مینمایند. بسیاری از
این گیرندهها
بعد از اتصال لیگاند دیمریزه میشوند؛ INSR یک استثناء بوده و قبل از اتصال انسولین، به صورت دیمر 2(ß α)
است.
اتصال پروتئینهای
تطبیقی مثل Grb2
به ریشه p-Tyr یک مکانیسم معمول
برای افزایش میانکنش پروتئین- پروتئین (RTKs) است.
علاوه بر بسیاری از
گیرندهها
که به عنوان پروتئین تیروزین کیناز (RTKs) عمل میکنند، تعدادی از پروتئینهای شبه گیرنده غشای
پلاسمایی، فعالیت پروتئین تیروزین فسفاتازی دارند. بر اساس ساختار این پروتئینها، گمان میرود که لیگاندهای آنها جزیی از ماتریکس
خارج سلولی و یا سطح دیگر سلولها باشد. اگرچه نقش پیامرسانی آنها به خوبی RTKها مشخص نشده، اما آنها قدرت معکوس کردن
اعمال پیامهای
تحریک کننده این کینازها را دارند.
انگیزه تکامل چنین
سیستم پیچیدهای چه بوده است؟ این
سیستم به یک گیرنده فعال شده توسط انسولین اجازه میدهد چندین مولکول1-IRS را فعال کرده و
باعث تقویت پیام انسولین گردیده و منجر به یکپارچگی پیام گیرندههای مختلفی مانند EGFR و PDGFR میگردد که هر کدام میتوانند1-IRS را فسفریله
نمایند. علاوه بر این چون 1-IRS میتواند هر کدام از چندین پروتئین حاوی دمینهای SH2 را فعال نماید،
یک گیرنده واحد که از طریق 1-IRS عمل میکند، میتواند دو یا تعداد بیشتری از مسیرهای پیامرسان را شروع نماید؛ انسولین از طریق
مسیر Grb2-SOs-Ras-MAPK بر بیان ژن تاثیر
گذاشته و از طریق مسیر PI3K-PKB بر متابولیسم گلیکوژن مؤثر است. در نهایت، چندین پروتئین IRS مرتبط به هم (2-IRS , 3-IRS) با ویژگیهای منحصر به فرد و
توزیع
بافتی و عملکردی وجود دارد که پیامرسانی در مسیرهای شروع شده با RTKs را غنی میکنند (4).
تنظیم
منفی و پایان سیگنال گیرنده انسولین
فسفوریلاسیون سرین -
گیرنده انسولین در صورت فقدان انسولین در محل باقیماندههای سرین و ترئونین فسفوریله میشود، این فرایند در
حضور استرهای
فوربول، بیان بالای ایزوفرمهای پروتئین کیناز C، فعال شدن چرخه پروتئین کیناز وابسته به cAMP، و خود انسولین
افزایش مییابد. یکی از جایگاهها، سرین 1305 و یا
1306 در پایانه C،
و دیگری در ناحیه مجاور غشا است. به نظر میرسد فسفوریلاسیون سرین قادر به مهار
انتقال سیگنال انسولین است. بهطور مشابه، فسفوریلاسیون سرین/ترئونین پروتئینهای IRS توسط کینازهای سلولی مختلف،
اثرهای منفی عمدهای
بر انتقال سیگنال انسولین، احتمالا بیشتر از خود گیرندهها دارد (1).
اینترنالیزه شدن و
بازیابی گیرنده ـ تعداد گیرنده سطح سلول بوسیله تنظیم خود انسولین مربوط است، از
طریق فرایندی که بهعنوان تنظیم کاهشی homologous down-regulation و یا حساسیتزدایی معروف است. یک رابطه معکوس بین
غلظت انسولین محیط و تراکم گیرنده در سطح سلول با مطالعه کشتهای سلولی در شرایط آزمایشگاهی و در
بسیاری از مدلهای
in vivo
در حیوانات و انسان نشان داده شده است.
کنترل عمده انسولین
بر تعداد گیرندهها
از طریق سطح تخریب گیرندههای اینترنالیزه شده است. گیرندههای انسولین علاوه بر نقش خود به عنوان
آغازگر آبشار انتقال سیگنال انسولین، واسطه درونی شدن مجموعه گیرنده ـ انسولین از
طریق اندوسیتوز نیز هستند. در داخل سلول، انسولین تخریب شده و خود گیرنده تا حد
زیادی به غشای پلاسمایی بازگردانده میشوند.
قرار گرفتن طولانی
مدت در معرض انسولین نیز میزان تخریب گیرنده را از طریق فرایند تنظیم کاهشی افزایش
میدهد. از آنجا که
گیرندههای
اینترنالیزه شده به نظر میرسد از طریق کینازها فعال باشند، ممکن است فعالیت کیناز
در برخی از جایگاههای داخل سلولی نقش مهمی در فعالیت انسولین بازی کند. به نظر میرسد حداقل دو مسیر
مجزا برای عملکرد درونی شدن انسولین وجود دارد: اولین مسیر، مربوط به ساختارهایی به نام coated pit
است، که به فعالیت کیناز رسپتور انسولین، تری فسفوریلاسیون در دامین تنظیم کننده
زیرواحد بتا و دو توالی ویژه تیروزینی در دامین مجاور غشایی وابسته است. مسیر دوم
که در برخی سلولها
مانند فیبروبلاستها
مطالعه شده است، غیرقابل اشباع شدنی و مستقل از فسفوریلاسیون گیرنده است و نقش
مهمی دارد (1).
منابع
1.
WHITTAKER J. STRUCTURE AND FUNCTION OF THE INSULIN RECEPTOR. WOLTERS KLUWER,
2015;1-20.
2.
GUYTON AND HALL. MEDICAL PHYSIOLOGY, SUNDERS, 2011.
3.GANONG
W F. MEDICAL PHYSIOLOGY, MCGRAW HILL. 2010.
4.
NELSON D L, COX M M. PRINCIPLES OF BIOCHEMISTRY. FREEMAN COMPANY. 2013.
5.
Saltiel a r and pessin j E. MECHANISMS OF INSULIN ACTION, SPRINGER.2007
6.
CASSIMERIS L ET AL. LEWIN'S CELLS, JONES & BARLETT, 2011
7.
HADLEY M E. ENDOCRINOLOGY, PRENTICE
HALL, 1988
پینوشتها
1.
up-regulated
2. furin
3. sub-domain
4. ecto-domain
5. insertion domain
6. HETEROGENICITY
7. NEGETIVE COOPERATIVITY
8. auto-inhibitory
9. platelet derived growth factor
10.Mitogen-activated protein kinases